晶体结构初步(化竞老物)
除了典型的金属具有金属键以外,d区元素的氧、硫化物也有一定的金属性,如 $\text{ReO}_{3}$ (红色金属光泽)、$\text{FeS}_{2}$ (愚人金)。金属键让金属具有延(拉长)展(压扁)性(不活泼金属较好)。
并非所有的金属化合物都是离子的,非金属化合物(如 $\text{NH}_{4}\text{NO}_{3}$ )也可能有离子键,还有一些材料同时具有离子键和金属键的特征。
离子键和金属键都没有方向性。
等径球密堆积
注意 hcp 中的空隙位置(可能出现Oh共面连接)


面心立方的另一种视角——所有的棱心和体心
金属的结构
注意只有 Po 为简单立方堆积
规律:sp 电子数少(IA)为 A2,中(IIA)为 A3,多(Al)为 A1
A1 的延展性高于 A3:金属晶体沿密度最高的原子层方向滑动(密堆积),而 A1 在4条体对角线方向都是密堆积。

合金

$\text{Fe}_{3}\text{C}$:
注意:螺旋上升的八面体:实际为 $\ce{Fe_{6\times\frac13}C}$

置换型(固溶体、混合物、不改变原有结构):半径相差小;单质晶体结构相似;电负性相似(否则形成化合物)。例:Cu-Ni;Cu-Zn($\text{α}$-黄铜)
填隙型(整比:化合物;非整比:固溶体;不改变原有结构):金属和小原子(B、C、N 等);半径判断(最大填入八面体而不影响原有堆积——0.732)
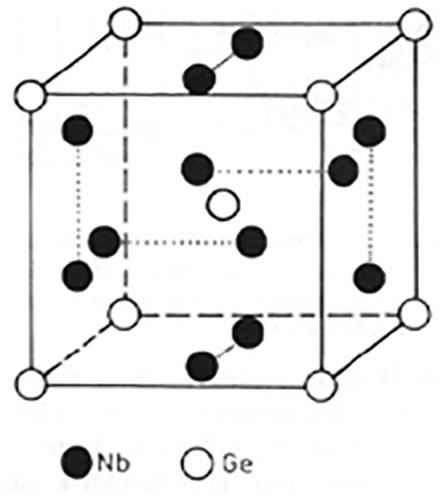
金属互化物(原有结构改变):$\text{β}$-黄铜、$\text{MgZn}_{2}$、$\text{Cu}_{3}\text{Au}$、$\text{NaTl}$、$\text{Na}_{5}\text{Zn}_{21}$、$\text{A}_{3}\text{B}$(A15型)……
$\text{MgZn}_{2}$:(注意 Mg 的14面体配位)


$\text{NaTl}$:两套金刚石:

A15相:坐标有0.25,不是正20面体!
$\text{LaNi}_{5}$ 型:一般都看的是大六棱柱,注意看配位:

金属互化物中高电正性+低电正性的(准)金属:Zintl相——等电子规则1。
更多 Zintl 相请见这个论文
记忆合金:例:Ni-Ti——低温:马氏体(四方)→高温:奥氏体(面心立方)
离子晶体的基本结构
二元
NaCl、CsCl($\text{CsCl}, \text{CsBr}, \text{CsI}, \text{TlCl}, \text{TlBr}, \text{TlI}, \text{CsSH}$)、ZnS(纤六方、闪立方)、CaF2、NiAs(八面体共面,As填三棱柱)、MoS2、
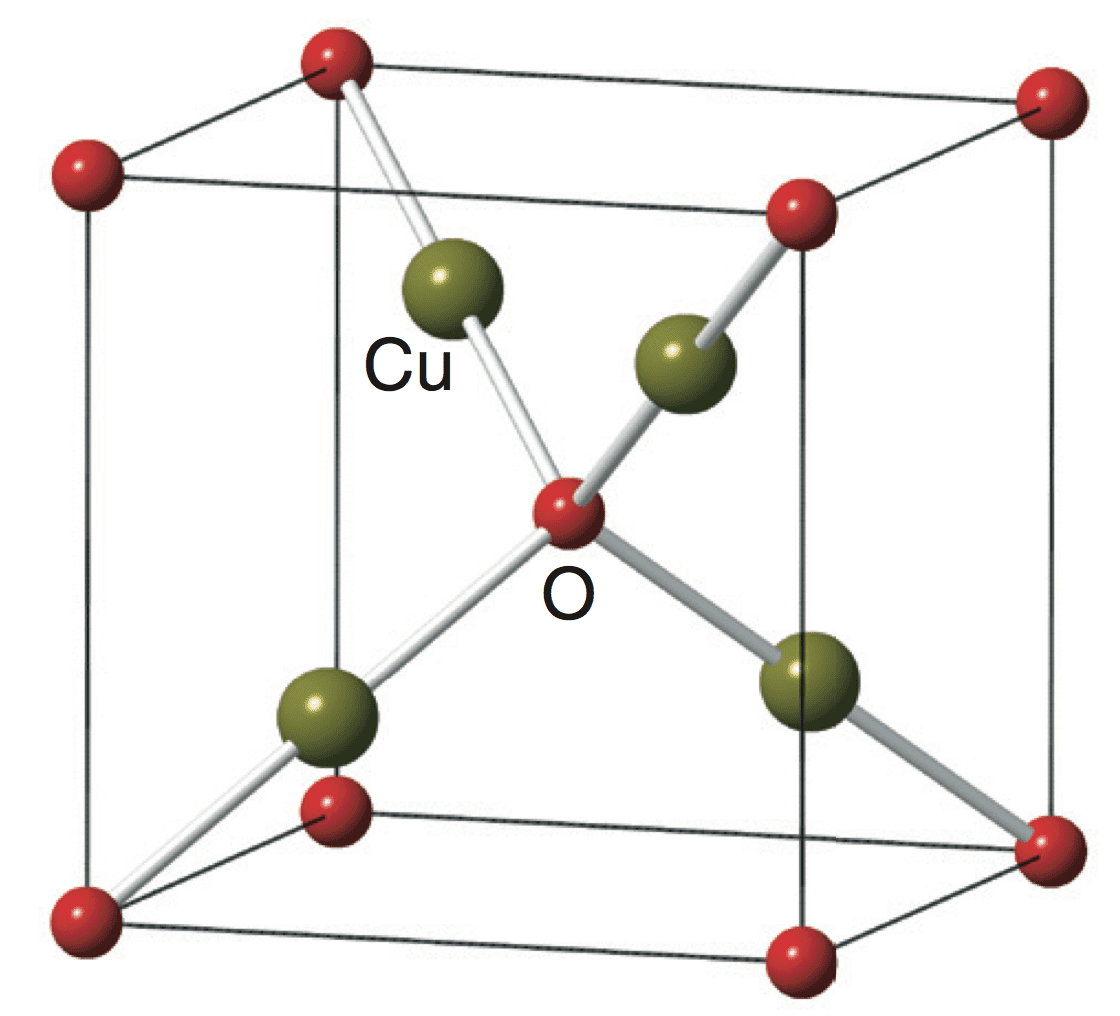
$\text{Cu}_{2}\text{O}$:两套反 $\text{SiO}_{2}$:注意晶胞十分简单:
$\text{HgI}_{2}$:

$\text{PdCl}_{2}$:

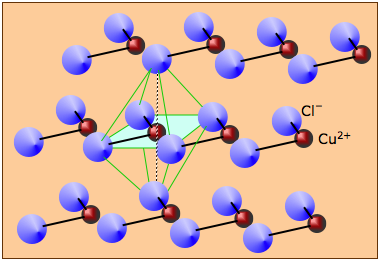
$\text{CuCl}_{2}$:[$\ce{CuCl4}$]连接成链,链之间交错,Cu 畸变八面体
$\text{BiI}_{3}$:

$\text{TiO}_{2}$:

金红石的新视角:O:畸变 hcp,Ti:一半 Oh:


注意金红石晶胞中 Ti-O(同层)的距离相等
PtS、PbO(InBi)结构:


$\text{CaCO}_{3}$(方解石和文石):
方解石:Ca:ABCABC、$\text{CO}_{3}^{2-}$:Oh 空隙(朝向:1,2,1,2,1,2)
文石:Ca:ABABAB、$\text{CO}_{3}^{2-}$:Oh 空隙(朝向:1,1,2,2),上下夹一层 Ca。文石是正交的——每一层 Ca 密堆积略分上下,不那么规则。

新视角:


接着,将两个碳酸根抽象成八面体→点:那么中间近似一个六边形,其中间隔的三个点→2×碳酸根(两组,朝向不同)→上下交错
$\text{Al}_{2}\text{O}_{3}$:刚玉

O:ABABAB;Al:C1C2C3C1C2C3(每种只填2/3八面体空隙)
总:AC1BC2AC3BC1AC2BC3
三元
$\text{CaTiO}_{3}$:另一种视角——注意是 Ca 和 O 共同堆积出 ccp(Ca:12配位)

尖晶石:$\text{MgAl}_{2}\text{O}_{4}$:(注意相同电性离子排斥)

判断正常——反常:
滑石($\text{Mg}_{3}\text{Si}_{4}\text{O}_{10}(\text{OH})_{2}$):

橄榄石:O(正交晶胞):类 hcp
注意
结构的类比与联想——数量比(加入空隙);价态(扩倍);阴阳(交换);种类(多种→一种;原子团→一种);形状(畸变:不规则原子团 or 氢键、共价键等带方向的作用);堆积方式——类似的立方→六方(六方尖晶石)(填隙方式类似)
C3 投影图的无敌画法(最好分层画):分数坐标转换——

缺陷
形成缺陷,$\Delta H>0, \Delta S>0$,高温、晶体较大时有利(状态数(W)更多,熵增更大)
几种类型
本征缺陷
Schottky 缺陷:粒子按化学计量比成对消失,在高配位结构(离子、金属等)中多见(MO 一氧化物)
Frenkel 缺陷:一种粒子移动到空隙(位置改变)例:$\text{AgCl}$ 中 Ag(Oh→Td);$\text{PbF}_{2}$ 的 F(Td→Oh),在低配为结构中较多——空隙较多较大
原子互换缺陷:两个不同粒子交换位置(二元离子中不多),如反式尖晶石
上面都不改变化学式,离子强,高配位——Schottky;共价强,低配位——Frenkel。
外赋缺陷
掺入杂质——电荷相等、大小相似;不能太多;掺杂通常改变固体电子结构(NP 结、$\text{ZrO}_{2}$ 中掺入 $\text{CaO}$ 导电)
色心:在碱金属蒸汽中加热碱金属卤化物(卤离子→电子,又叫 F-心)or X 射线照射(使得电子电离):$\text{NaCl}$(橙)、$\text{KCl}$(紫)、$\text{KBr}$(蓝绿)
宝石则单独一篇 blog。
扩展缺陷
晶体的剪切面——Wadsley 缺陷
从 a 轴看 $\text{ReO}_{3}$ 的变化:步骤:画线→删除(阴离子)→平移拼接

$\text{WO}_{3-x}$ 中共边的八面体(联想像素画、光栅化):

Ti 的低级氧化物:
数法:1.找最小单元(几个 Ti 重复?),找到参考点 2.画线(连接参考点) 3.数原子数(部分穿过的看圆心穿过没有)

原子和离子扩散
强烈依赖于缺陷——一般很慢很难。几种机理:

非计量化合物和固溶体
非计量化合物含有混合氧化态,通常发生在多氧化态的 d、f 区和 p 区较重元素中,总的来说,该金属越容易变价越容易出现非计量化合物。
固溶体:化学计量发生连续变化而结构不变,仍然包括价态变化,甚至会出现奇怪的价态($\text{La}_{1-x}\text{Sr}_{x}\text{FeO}_{3}$ 中 $\text{Fe}(\text{IV})$)。不少 $\text{CaTiO}_{3}$ 结构、$\text{MgAl}_{2}\text{O}_{4}$ 结构可以混在一起。也可以不要氧化态变化而产生缺陷($\text{La}_{1-x}\text{Sr}_{x}\text{FeO}_{3-y}$)
- 不要轻易的与二周期物质等电子! ↩